本文共1329字
心臟衰竭到末期不只有換心一途,未來將有新藥可施以投放!國際製藥大廠Biopeutics Co. Ltd將最快在3年內上市一種用於末期心臟衰竭疾病的新藥。已於去年12月在美國食品與藥物管理局(Food and Drug Administration,FDA) 進行TYPE-C會議臨床試驗文件審核電話會議,並於今年5月獲歐洲藥物管理局(European Medicines於Agency,EMA)核准進行第三期(F3)臨床試驗,Biopeutics公司將在11至12月開始進行F3臨床試驗。預計在2027年獲得美國食品與藥物管理局(FDA)和歐洲藥物管理局(EMA)批准上市和銷售。

舊藥新用 鎖定四級心衰患者
該新藥為舊藥新用,維也納醫科大學(MUV)用藥超過20年,是奧地利核可用藥,該醫療技術資料被FDA/EMA接受,直接進入第三期臨床試驗。一旦通過FDA/EMA核准 ,受法令保障,美國3+2年,歐盟8+2年,將成為新的智慧財產權。
Biopeutics公司與維也納醫科大學和醫療中心簽訂獨家協定,為四級心臟衰竭患者行銷和分銷PGE1(EUBEATLINE) 藥物。該智慧財產權協議於2019年11月由維也納醫科大學的 Michaela Fritz博士簽署。

Biopeutics公司成立於2006年,登記於英屬開曼群島,擁有世界級指導委員會,成員為歐美資深心臟衰竭的醫生/教授。主席Milton Packer是美國心臟衰竭教父及FDA長期資深顧問,負責與臨床試驗證據的設計和解釋相關的事務,並擔任20項大型國際心臟衰竭試驗的首席研究員。維也納團隊(Martin Huelsmann博士和醫師Noemi Pavo及公司醫療顧問醫師王培國,在1990年代開發了前列腺素(PGE1,Prostaglandin E1)藥物,用於橋接心臟移植患者。隨後被奧地利當局批准,用於治療心臟衰竭末期患者。
Biopeutics公司開發的末期心臟衰竭治療藥物稱其有效化學物質是前列腺素E1(prostaglandin E1,PGE1或稱為 Alprostadil ALP)係氧化酵素產生的自然的化學物質,對肺臟與血管擴張作用具有效性,並具有其他特性如抑制血小板凝結與促進細胞增殖等。PGE1係重要的內在調節因數,透過調節血管收縮功能,來調節供應予身體之各個重要器官的血液流量。
歐洲奧地利核准使用PGE1,作為心臟衰竭病人心臟移植前的治療超過10年以上。
風險相對低 非強烈侵略性治療
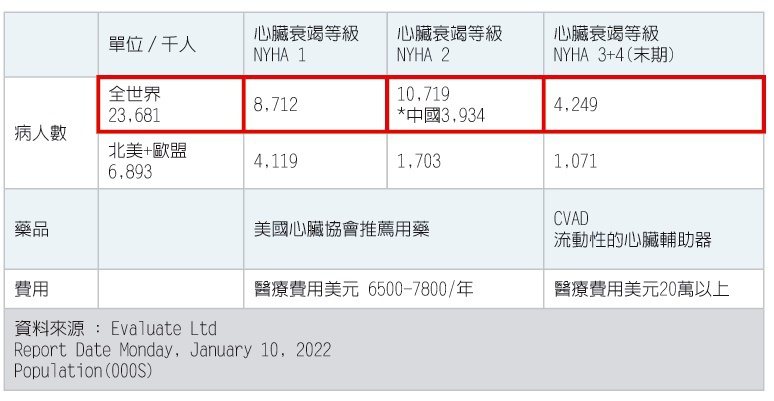
Biopeutics公司表示,該新藥本身不是一個強烈侵略性的治療方式,病人不必施行心臟手術來放心臟輔助器,兩年的存活率差不多,其風險較低。這兩年可以作為等待心臟捐獻者的過度期,相較起心臟輔助器的費用便宜很多。Biopeutics公司預計2027年獲得美國食品與藥物管理局(FDA)和歐洲藥物管理局(EMA)的最終批准出售新藥。該公司預計第一年目標市占率(同穿透率)為5%,2028年為10%,2029年為15%。2019年WHO報告:全球最主要的死亡原因(按死亡總人數排列)與三個大主題有關:心血管疾病(缺血性心臟病)、腦血管疾病、及呼吸系統疾病。估計2025年慢性心臟衰竭人口97,105(千)人。
※ 歡迎用「轉貼」或「分享」的方式轉傳文章連結;未經授權,請勿複製轉貼文章內容





留言