本文共844字
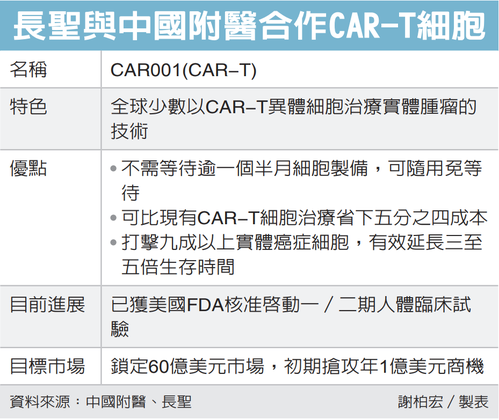
長聖(6712)昨(21)日宣布,美國食品藥物管理局(FDA)正式核准長聖的新藥CAR001進行人體一期、二期臨床試驗,成為全球極少數以異體CAR-T細胞治療實體腫瘤的臨床試驗案例。長聖表示,CAR-T被公認為治療癌症最有效的細胞產品,未來將有機會搶進全球百億美元細胞治療市場商機。
相較於現有細胞療法,長聖指出,CAR-T擁有三大優勢,首先是不需等待逾一個半月細胞製備,可隨用免等待;第二是較現有細胞療法省下五分之四成本;第三,動物實驗證明超過九成實體腫瘤被消滅,可有效延長患者三至五倍生存時間。
長聖董事長劉銖淇強調,這項新藥將讓全球癌症患者對治療更有信心。長聖總經理黃文良說,雖在申請美國臨床試驗過程中遇到挑戰,但經研究團隊努力後,成功在30天內將CAR001新藥推進到Phase I/IIa臨床試驗階段,且全球已有多家藥廠正與長聖洽談授權。
長聖表示,CAR001將開啟癌症治療晚期及難治性實體腫瘤(包括大腸直腸癌、乳癌、肺癌和腦癌)的新世代,其具有現貨供應的優勢,為患者提供方便有效的治療選擇。
長聖強調,致力於科學研究,並具備生產能力,從健康捐贈者細胞採集、電轉染、改造到大規模生產的完整過程,具有一站式的開發與生產能力。
長聖指出,目前國際已上市的CAR-T細胞產品有七項,全數是以自體細胞來對抗血液腫瘤,但這些細胞療法有兩大缺點,一是適應症尚未廣泛應用於實體腫瘤治療,但是癌症約有80%屬於實體腫瘤;此外,已上市的CAR-T細胞產品必須使用自體細胞進行改造,製備過程耗時約一至二個月、品質不穩定,且單一療程要價40萬美元。
長聖說明,CAR001是利用人工智慧(AI)篩選出關鍵的實體腫瘤人類白血球抗原G(HLA-G)靶點,並使用mRNA改造的「異體非病毒基因編輯多靶向奈米抗體-CAR.BiTE-γδT免疫細胞」突破性CAR-T技術。近年與中國醫藥大學附設醫院院長周德陽研究團隊合作,是全世界第四例以Gamma Delta-T細胞為載體,發展出治療實體腫瘤的異體CAR-T細胞療法。
※ 歡迎用「轉貼」或「分享」的方式轉傳文章連結;未經授權,請勿複製轉貼文章內容









留言